浙江省第二类医疗器械注册变更资料要求与第一类医疗器械销售规范解析
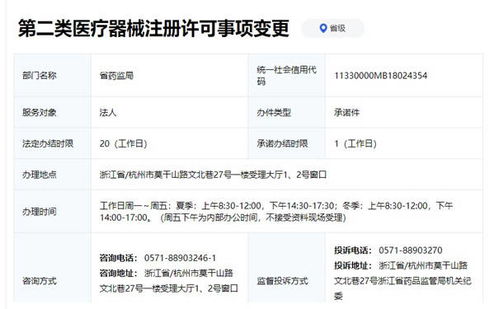
在医疗器械行业的合规经营中,企业不仅需要关注产品的注册准入,还需对已获证产品的变更管理以及不同类别产品的销售活动有清晰的认识。本文将聚焦于浙江省第二类医疗器械的注册变更资料要求,并简述第一类医疗器械的销售相关规范,为相关从业者提供参考。
一、 浙江省第二类医疗器械注册变更资料要求
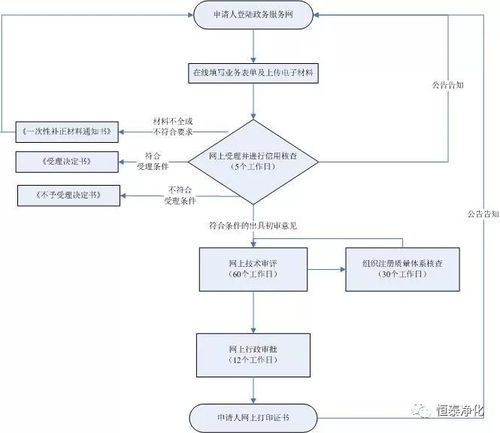
根据国家药品监督管理局(NMPA)发布的《医疗器械注册与备案管理办法》及相关配套文件,并结合浙江省药品监督管理局的具体执行要求,第二类医疗器械注册证持有者在产品注册证有效期内,若发生需要变更的事项,必须向原注册部门(浙江省药监局)提交变更申请。变更类型主要分为登记事项变更和许可事项变更。
1. 变更类型区分
- 登记事项变更:指注册人名称和住所、代理人名称和住所等事项的变更。此类变更相对简易。
- 许可事项变更:指产品名称、型号、规格、结构及组成、适用范围、产品技术要求、进口医疗器械的生产地址等可能影响产品安全性、有效性的实质性变更。此类变更要求严格,通常需要提交详实的技术资料。
2. 通用资料要求核心清单
无论何种变更,申请人均需提交基础性文件,但根据变更内容的不同,技术性资料的深度和广度差异显著。核心通用资料通常包括:
- 医疗器械注册变更申请表。
- 证明性文件:如企业营业执照副本、原医疗器械注册证及其附件复印件。
- 注册人关于变更情况的声明,承诺变更内容真实、合法。
- 关于变更情况相关的说明材料。
3. 许可事项变更的技术资料重点
对于涉及产品技术本身的许可事项变更,是资料准备的核心与难点,可能要求提交:
- 变化情况对比表及说明:详细列明变更前后所有技术内容、性能指标、临床评价资料等的变化,并阐述变化原因及依据。
- 修订后的产品技术要求:完整版本,并标注所有变更处。
- 针对变化部分的研究资料:包括但不限于设计验证、工艺验证、风险分析更新、生物相容性评价(若涉及)、灭菌验证(若涉及)、稳定性研究等。变更可能对产品安全性、有效性产生影响的,需提供充分证据。
- 临床评价资料:如果变更可能影响产品的临床使用安全性或有效性,可能需要通过临床试验、同品种对比或临床文献数据等方式,补充或更新临床评价资料。
- 产品检验报告:通常需要提供具有医疗器械检验资质的机构出具的、符合修订后产品技术要求的注册检验报告。
- 符合性声明:声明变更后的产品符合现行法规及强制性标准的要求。
4. 浙江省地方性要求提示
企业应密切关注浙江省药监局官方网站发布的办事指南、通知公告,了解最新的表格格式、电子申报系统使用要求、纸质材料递交方式等具体流程细节。建议在准备资料前,与省局相关受理或技术审评部门进行预先沟通。
二、 第一类医疗器械销售规范简述
与第二类医疗器械的注册管理不同,第一类医疗器械实行产品备案管理。其生产活动由设区的市级药品监督管理部门备案,而销售活动的监管重点在于经营行为的合规性。
1. 经营资质要求
- 从事第一类医疗器械销售的企业,无需办理《医疗器械经营许可证》。
- 但经营者应当具备与其经营规模和范围相适应的经营场所和贮存条件,以及相应的质量管理制度和专业人员。
- 根据《医疗器械经营监督管理办法》,从事医疗器械批发业务的企业,其销售对象必须是具备合法资质的医疗器械生产经营企业或使用单位。
2. 合规销售要点
- 产品合法性:确保所销售的第一类医疗器械已取得有效的医疗器械备案凭证,产品标签、说明书内容与备案信息一致。
- 进货查验记录:必须建立并执行进货查验记录制度,记录内容包括产品名称、型号、规格、生产批号、有效期、备案人/生产企业名称、供货者名称及联系方式、进货数量、进货日期等。相关记录和凭证需保存至产品有效期后2年,且不少于5年。
- 销售记录:特别是从事批发业务的企业,应建立销售记录制度,确保产品可追溯。
- 广告宣传:医疗器械广告内容必须真实、合法,以药品监督管理部门批准的注册/备案证明文件为准,不得含有虚假、夸大内容。
- 网络销售:若通过网络销售第一类医疗器械,应依法向所在地设区的市级药品监督管理部门办理经营备案,并在其主页面显著位置展示其医疗器械经营备案凭证等信息。
三、
对于浙江省的医疗器械企业而言,第二类医疗器械的注册变更是一项严肃的技术评审过程,要求企业系统、严谨地准备资料,尤其是证明变更不影响安全有效的核心技术文件。而对于第一类医疗器械的销售,虽然准入门槛较低,但事中事后的合规经营责任同样重大,企业需建立健全质量管理体系,确保产品来源清、去向明,合法合规开展销售活动。两者共同构成了医疗器械全生命周期管理的重要环节,是企业稳健发展的基石。
如若转载,请注明出处:http://www.tbsaasmall.com/product/23.html
更新时间:2026-02-11 06:16:49