浙江药监7月批准84个第二类医疗器械产品注册,市场准入与销售迎来新机遇
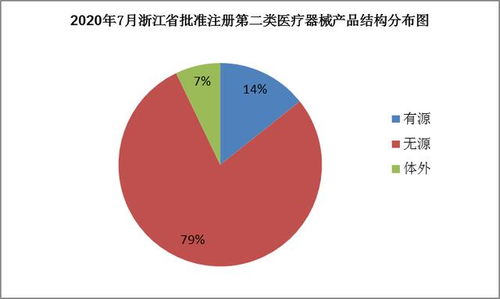
浙江省药品监督管理局发布了7月份医疗器械产品注册审批结果,共批准注册第二类医疗器械产品84个。这一数据不仅反映了浙江省医疗器械产业的创新活力,也为相关产品的市场销售与临床应用提供了新的准入通道。
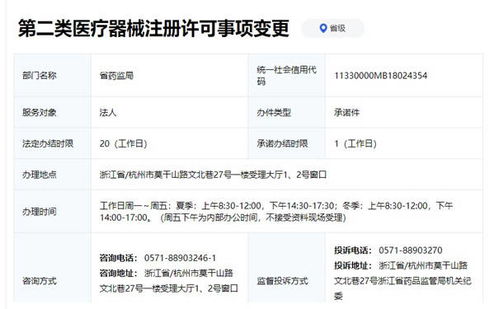
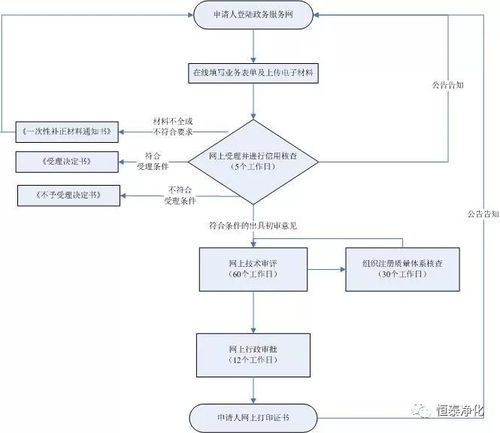
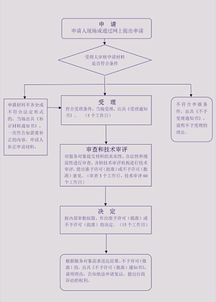
第二类医疗器械是指对其安全性、有效性应当加以控制的医疗器械,例如体温计、血压计、医用缝合针、超声诊断设备等。根据《医疗器械监督管理条例》,第二类医疗器械实行产品注册管理,需由省级药品监督管理部门审查批准后,方可生产、销售和使用。浙江省药监局的此次审批,体现了对医疗器械安全性与有效性的严格把关,同时也为本土企业创新产品的市场化进程注入了动力。
从审批结果来看,获批产品涵盖了多个临床领域,包括体外诊断试剂、物理治疗设备、医用耗材等。这些产品的上市,将有助于提升浙江省乃至全国的医疗服务水平,满足多样化的临床需求。例如,部分新型体外诊断试剂可助力疾病早期筛查,而先进的物理治疗设备则为康复医学提供了更多选择。
对于医疗器械销售而言,此次84个产品的获批意味着市场供给的进一步丰富。销售企业需密切关注这些新获证产品的特点与适用范围,以便精准对接医疗机构和患者需求。销售过程中必须严格遵守医疗器械经营质量管理规范,确保产品流通环节的可追溯性与安全性。值得注意的是,随着医疗器械“线上+线下”销售模式的普及,相关企业也需加强网络销售资质的合规管理,防止未经注册或备案的产品流入市场。
浙江省作为我国医疗器械产业的重要集聚区,一直致力于优化审评审批流程,激发企业创新潜能。此次集中批准84个第二类医疗器械产品,不仅展示了产业发展的积极态势,也为全国医疗器械监管提供了地方实践样本。随着监管政策的持续完善与技术进步,预计将有更多安全、有效的医疗器械产品获批上市,惠及公众健康。
对于行业从业者而言,应以此为契机,加强研发创新与质量管理,同时深入理解监管要求,确保产品全生命周期的合规性。唯有如此,才能在激烈的市场竞争中赢得先机,推动医疗器械行业的高质量发展。
如若转载,请注明出处:http://www.tbsaasmall.com/product/18.html
更新时间:2026-02-11 10:04:17