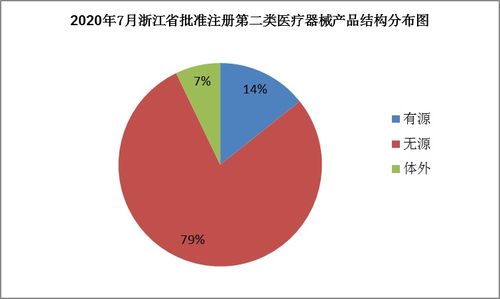
医用防护口罩与防护服注册证合规获取及第二类医疗器械销售全攻略
在当前公共卫生需求日益凸显的背景下,医用防护口罩和防护服作为关键的防护物资,其市场准入与合规销售备受关注。这些产品属于第二类医疗器械,其生产、注册与销售受到国家药品监督管理局的严格监管。为确保产品安全有效并合法进入市场,相关企业必须遵循明确的法规路径。本文将系统阐述医用防护口罩和防护服医疗器械注册证的正确获取方式,并详解第二类医疗器械的销售合规要点。
一、 医用防护口罩与防护服注册证的正确获取方式
获取医疗器械注册证是产品上市销售的前提。对于医用防护口罩(通常属于医用防护口罩,如符合GB 19083标准)和防护服(如符合GB 19082标准),其注册流程严谨且必须依法进行。
1. 前期准备与产品分类界定
- 明确产品属性与分类:首先需确认产品属于第二类医疗器械。医用防护口罩和医用防护服通常划归第二类,具体可依据《医疗器械分类目录》或通过向省级药品监督管理部门申请分类界定来确认。
- 建立质量管理体系:生产企业必须建立符合《医疗器械生产质量管理规范》(GMP)的质量管理体系,并通过现场核查。这是注册申报的基础。
2. 产品检验与临床评价
- 注册检验:将产品样品送至具有相应资质的医疗器械检验机构进行注册检验。检验需依据国家强制性标准(如GB 19083、GB 19082)及产品技术要求进行,获取合格的检验报告。
- 临床评价:根据《医疗器械临床评价技术指导原则》,大多数医用防护口罩和防护服可通过同品种比对路径(即与已上市同类产品进行比对)完成临床评价,无需开展临床试验。需提交详细的比对资料和论证报告。
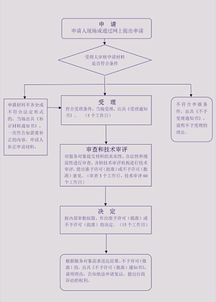
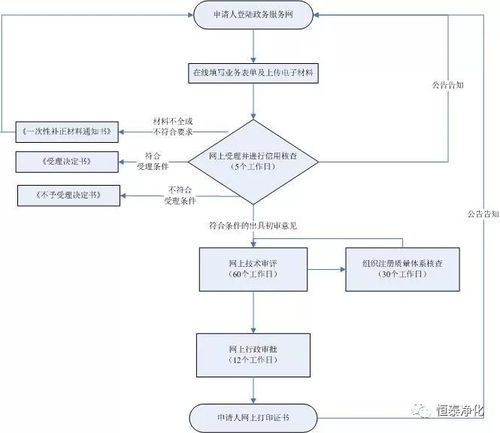
3. 注册申请与审评审批
- 准备注册申报资料:按照《医疗器械注册管理办法》及相关指导原则,编制完整的注册申报资料。核心文件包括:申请表、证明性文件、医疗器械安全有效基本要求清单、研究资料(含产品性能研究、生物相容性评价等)、产品技术要求、检验报告、临床评价资料、产品说明书及标签样稿、生产制造信息等。
- 提交申报:通过国家药品监督管理局网上办事大厅或线下窗口,向国家药监局医疗器械技术审评中心提交注册申请。
- 技术审评与体系核查:审评中心对资料进行技术审评,必要时发出补正通知。药品监督管理部门可能对生产场地进行质量管理体系现场核查。
- 审批发证:审评通过后,国家药监局作出准予注册的决定,核发《医疗器械注册证》。注册证载明产品名称、型号规格、结构组成、适用范围、注册人等信息,有效期通常为5年。
4. 生产许可衔接
获得注册证后,生产企业还需向所在地省级药品监督管理部门申请《医疗器械生产许可证》,其中应包含该产品的生产范围。只有“证照齐全”(注册证+生产许可证),方可正式生产上市。
二、 第二类医疗器械销售合规要点
取得注册证后,产品进入流通环节。销售第二类医疗器械(包括医用防护口罩和防护服)必须严格遵守相关法规,确保供应链可追溯、质量安全可控。
1. 经营资质要求
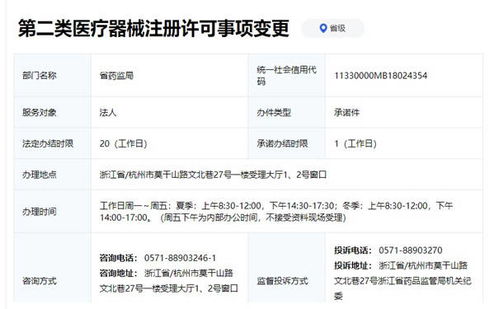
- 经营企业备案:从事第二类医疗器械经营的企业,无需办理经营许可证,但应当向所在地设区的市级药品监督管理部门进行经营备案,获取《第二类医疗器械经营备案凭证》。这是合法销售的基本资质。
- 人员与条件:企业需具备与经营规模和范围相适应的质量管理机构或人员、经营场所、贮存条件等,并建立覆盖采购、验收、贮存、销售、运输等环节的质量管理制度。
2. 购销管理规范
- 供应商审核:经营企业必须从具有合法资质的医疗器械注册人、备案人或生产经营企业采购产品。需审核并留存供货方的医疗器械注册证、生产许可证(或备案凭证)、营业执照等证明文件。
- 产品验收与记录:建立进货查验记录制度,核实产品注册证信息、合格证明文件,并记录产品名称、规格型号、注册证号、生产批号、有效期、购销数量等信息。记录应真实、准确、完整,保存至产品有效期后2年,且不少于5年。
- 销售对象合规:应将产品销售给具有合法资质的医疗器械经营企业或使用单位(如医院、诊所)。销售时应提供随货同行单,并建立销售记录制度。
3. 储运与售后服务
- 储存与运输:必须按照产品说明书或标签标示的要求进行储存和运输,确保产品在流通环节的质量稳定。特别是防护物资,需注意环境温湿度、防尘防污染等要求。
- 不良事件监测:注册人/备案人和经营企业均应建立医疗器械不良事件监测体系,主动收集、报告、评价不良事件信息。
- 信息追溯:鼓励采用信息化手段实现医疗器械追溯,确保产品来源可查、去向可追、责任可究。
4. 网络销售特别规定
若通过互联网销售,企业除需完成经营备案外,还应向省级药品监督管理部门办理网站备案,并在其主页面显著位置展示医疗器械经营备案凭证、产品注册证等信息。平台入驻商家亦需审核其资质。
###
合规是医用防护口罩、防护服等第二类医疗器械生命线。企业从产品注册到市场销售,必须牢固树立法规意识,精准把握注册申报的技术与法规要求,严格落实经营环节的质量管理责任。唯有如此,才能确保安全有效的防护产品顺利送达使用者手中,在保障公众健康的实现企业的稳健长远发展。建议企业在实际操作中,密切跟进国家药监局发布的最新法规与标准动态,必要时咨询专业法律或注册顾问,确保全程合规。
如若转载,请注明出处:http://www.tbsaasmall.com/product/20.html
更新时间:2026-02-11 19:28:23